
 |
| Главная -> Книги (0) (1) (2) (3) (4) (5) (6) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17) (18) (19) (20) (21) (22) (23) (24) (25) (26) (27) (28) (29) (30) (31) (32) (33) (34) (35) (36) (37) (38) (39) (40) (41) (42) (43) (44) (45) (46) (47) (48) (49) (50) (51) (52) (53) (54) (55) (56) (57) (58) (59) (60) (61) (62) (63) (64) (65) (66) (67) (68) (69) (70) (71) ( 72 ) (73) (74) (75) (76) (77) (78) (79) (80) (81) (82) (83) (84) (85) (86) (87) (88) (89) (90) (91) (92) (93) (94) (95) (96) (97) (98) (99) (100) (101) (102) (103) (104) (72) 19. Улучшает ли ретроградная церебральная перфузия результаты операции восстановления дуги аорты? При тщательном внимании к деталям ретроградная мозговая перфузия удлиняет безопасную продолжительность остановки кровообращения и способствует ускорению послеоперационного неврологического восстановления. Эффективность этого метода обусловлена более однородным охлаждением мозга, изгнанием воздуха и других возможных эмболизирую-щих веществ, а также метаболической поддержкой (последнее положение является предметом дискуссий). Перфузионное давление >25 мм ртст. в верхней полой вене может быть опасным и неэффективным в плане увеличения безопасности остановки кровообращения. 20. Каковы результаты лечения больных с расслаивающей аневризмой аорты? При адекватном лечении в острой фазе общие уровни 5- и 10-летней выживаемости составляют 80 и 40% соответственно, вне зависимости от типа расслоения. 50% отдаленных летальных исходов обусловлены осложнениями со стороны сердца. Практически все пациенты с аневризмой типа А по Стэндфордской классификации (типы I и П по де Бейки) без хирургического лечения умирают в течение 60-90 дней. При этом основной причиной смерти является разрыв аорты. Напротив, при расслаивающих аневризмах типа В (тип П1 по де Бейки) прогноз гораздо лучще, хирургическое лечение показано только при наличии осложнений. Для аневризм типа А ранняя послеоперационная летальность составляет 10%. Этот показатель увеличивается до 12% при вовлечении дуги аорты и снижается до уровня менее 10% при аневризмах типа В, когда показано хирургическое лечение. 5-летняя выживаемость составляет 56-87% при поражении восходящей аорты, 56% для дуги аорты, 80-90% для нисходящей аорты. Вне зависимости от характера начальной терапии выжившим пациентам требуются пожизненное наблюдение и антигипертензивная терапия. 21. Следует ли пытаться до операции определить расположение спинномозговых артерий с помощью ангиографии, чтобы уменьшить послеоперационную параплегию или предотвратить ее? Нет Ангиография спинного мозга не оказывает влияния на результаты хирургического лечения грудных и торакоабдоминальных расслаивающих аневризм. 22. Каковы наиболее значимые детерминанты неблагоприятных исходов лечения расслаивающей аневризмы типа А? 1. Предоперационный щок. 2. Предоперационное сердечно-сосудистое осложнение. 23. Какая методика стала революцией в хирургическом лечении пациентов с расслаивающими аневризмами аорты типа В? Эндоваскулярная хирургия с имплантацией покрытых аортальных стентов. 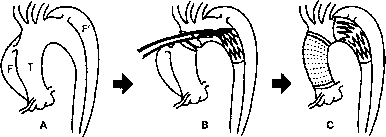 Рис. 48-1. А. Острая расслаивающая аневризма типа П и хроническая расслаивающая аневризма типа 111 (по классификации де Бейки). Дуга аорты не расслоена (Т - истинный просвет; F - ложный просвет при остром расслоении; F- ложный просвет при хроническом расслоении). В. При помощи футляра стент вводится в истинный просвет нисходящей аорты. С Восходящая часть аорты протезирована обычным образом (с разрешения Takeshi Miryairi, M.D.). ЛИТЕРАТУРА 1. Bavaria JE, Brinster DR, German RC: Advances in the treatment of acute type A dissection. An integrated approach. Ann Thorac Surg 74: S1853-S1856, 2002. 2. Bavaria JE, Pochettino A: Retrograde cerebral perfusion (RCP) in aortic arch surgery. Efficacy and possible mecha- nisms of brain protection. Semin Thorac Cardiovasc Surg 9:222-232, 1997. 3. Buffolo E, Fonseca JH, Souza JAM, et al: Revolutionary treatment of aneurysms and dissection of descending aorta. The endovascular approach. Ann Thorac Surg 74: S1815-S1817, 2002. 4. Erbel R, Zamorano J: The aorta, aortic aneurysm, trauma and dissection, Crit Care Clin 12:733-766, 1996. 5. Furthmayr H, Francke UTA: ascending aortic aneurysm with or without features of Marfan syndrome and other fib- rillinopathies. New insights. Semin Thorac Cardiovasc Surg 9:191-205, 1997. 6. Kenji M, Korck M, Hagl C: The impast of spinal angiography on the neurological outcome after surgery on the desending thoracic and thoracoabdominal aorta. Ann Thorac Surg 74: SI870-1872, 2002. 7. Kouchoukos NX Dougenis D: Surgery of the thoracic aorta. N Engl J Med 336:1876-1888, 1997. 8. Lintott P, Hafez HM, Stansby G: Spinal cord complications of thoracoabdominal aneurysm surgery. Br J Surg 85:5-15, 1998. 9. Loick HM, Scheld HH, Van Aken H: Impact of perioperative transesophageal echocardiography on cardiac surgery. Thorac Cardiovasc Surg 45:321-325, 1997. 10. May J, White G, Yu W, et al: Endoluminal repair of atypical dissecting aneurysm of descending thoracic aorta and fusiform aneurysm of the abdominal aorta. J Vase Surg 22:167-172, 1995. 11. Miyairi T, Ninomiya M, Endoh M, et al. Conventional repair and operative stent-grafling for acute and chronic aor- tic dissection. Ann Thorac Surg 73:1621-1623, 2002. 12. Petre R, \bn Segesser LK: Aortic dissection. Lancet 349:1461-1464, 1997. 13. SakaiT, Miki S, Ueda Y, et al: Spontaneous retrograde dissection of the entire thoracic aorta originating in the abdom- inal aorta. Case report and review of the literature. J Cardiovasc Surg 39:25-30, 1998. 14. Saku U, Takeda Y, Nil X et al. Three-dimensional spiral computed tomography angiography as an alternative imag- ing for a silent dissecting aortic aneurysm - a case report. Angiology 48:1067-1071, 1997. 15. Stewart M, Curtis GT, Daniel PR, et al: Preoperative shock determines outcome for acute type A aortic dissections. Ann Thorac Surg 75:525-529, 2003. 16. Svensson LG: New and future approaches for spinal cord protection. Semin Thorac Cardiovasc Surg 9:206-221, 1997. 17. Yun KL, Miller C: Ascending aortic aneurysm and aortic valve disease. What is the most optimal surgical technique? Semin Thorac Cardiovasc Surg 9:233-245, 1997. ХК Послеоперационное лечение 49. СТАНДАРТНЫЕ ПОСЛЕОПЕРАЦИОННЫЕ МЕРОПРИЯТИЯ Paulo R. Soltoski, M.D., and Nazah Youssef, M.D. 1. Опишите, как осуществляется перевод пациента в отделение интенсивной терапии. Перевод должен быть настолько безопасным, насколько это возможно. Как и во всех прочих отраслях медицины, здесь профилактика - основная тактика. Никогда не переводите нестабильного пациента! Проверьте искусственную вентиляцию легких (аускультация легких) и уровень оксигенации крови (пульсоксиметр). Это важно сделать, так как перекладывание с операционного стола на носилки может вызвать смещение интубационной трубки или внутривенного катетера. По необходимости для обеспечения адекватной гемодинамики добавьте препараты инотропной поддержки. Перед тем как покинуть операционную, проверьте баллон с кислородом, подключите монитор давления и откалибруйте его. Во время переноски пациента катетеры натягиваются, системы для внутривенных вливаний могут рассо-единиться, и тогда давление у пациента упадет Лучшим способом профилактики этих осложнений является выработка определенной методики и безукоризненное следование ей. 2. Что происходит в течение первого часа после операции? Первый послеоперационный час у больщинства пациентов определяет дальнейшее развитие событий. Поэтому для того, чтобы обеспечить безопасное восстановление больного, придерживайтесь нескольких правил. Обследуйте пациента сразу после его доставки в отделение: прослушайте дыхание, проверьте и перезапустите все мониторы. Если установлен кардиостимулятор, посмотрите, действительно ли он эффективно функционирует Проверьте дренажные трубки - осуществляют ли они адекватное дренирование грудной полости или уже закупорились сгустками крови? Если осторожное отсасывание неэффективно, может потребоваться активное отсасывание содержимого в стерильных условиях. Частым состоянием при переводе в отделение интенсивной терапии является гипотер.мия, которую следует устранить немедленно. Оставайтесь с пациентом до тех пор, пока не получены удовлетворительные результаты лабораторных анализов, рентгенографии грудной полости и электрокардиографии. 3. Какие установки аппарата искусственной вентиляции легких являются адекватными для перевода больного в отделение интенсивной терапии? Установите содержание кислорода во вдыхаемом воздухе (Fi02) на самом низком уровне, обеспечивающем насыщение гемоглобина кислородом >95%. Помните, что в раннем послеоперационном периоде конечности пациента остаются холодными и показания пульсоксиметра на пальце могут быть неточными, поэтому используйте уши или нос. Установите частоту дыхательных движений на уровне 12-16 в 1 мин, объем потока - 6-8 мл/кг массы тела, максимальное давление вдоха - менее 35 мм вод.ст При необходимости повышения уровня Fi02 до величин >0,4 можно добавить режим положительного давления в конце выдоха (ПДКВ). Показано, что у больных со сниженной фракцией изгнания в раннем послеоперационном периоде режим ПДКВ уменьшает постнагрузку на левый желудочек, раскрывает альвеолы, улучшает оксигенацию и деятельность сердца. 4. Когда и каким образом пациент должен быть отключен от аппарата искусственной вентиляции легких? В идеале пациент должен находиться в сознании, быть гемодинамически стабильным и способным адекватно защищать собственные дыхательные пути. Тем не менее, пациенты. (0) (1) (2) (3) (4) (5) (6) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17) (18) (19) (20) (21) (22) (23) (24) (25) (26) (27) (28) (29) (30) (31) (32) (33) (34) (35) (36) (37) (38) (39) (40) (41) (42) (43) (44) (45) (46) (47) (48) (49) (50) (51) (52) (53) (54) (55) (56) (57) (58) (59) (60) (61) (62) (63) (64) (65) (66) (67) (68) (69) (70) (71) ( 72 ) (73) (74) (75) (76) (77) (78) (79) (80) (81) (82) (83) (84) (85) (86) (87) (88) (89) (90) (91) (92) (93) (94) (95) (96) (97) (98) (99) (100) (101) (102) (103) (104) |
|
|